- 2023-11-30 23:21:58 聚宏信金属谈医用钛合金棒丝材表面微裂纹无损检测
引言
随着人口老龄化的加速,与骨相关的疾病日益增多。骨质疏松症涉及全球2亿多人,是一个严重的公共卫生问题,因此需要高性能的生物植入体来替代或帮助骨组织修复与再生[1,2]。在生物医学领域,钛及其合金具有生物相容性好、比强度高、弹性模量好、韧性好、人骨不排斥、耐腐蚀性好等优点,而被广泛应用于人体骨组织的修复和更换[3]。由于钛合金表面容易在空气中氧化产生生物惰性氧化膜,导致涂层表面骨细胞附着率降低、骨组织修复周期延长,甚至造成植入失败。解决这一问题最有效的方法是对钛合金进行表面处理,制备具有良好生物相容性的表面复合涂层。目前,医用钛合金表面改性的方法大致可以分为化学镀、溶胶凝胶[4]、等离子喷涂[5]、电沉积和微弧氧化[6]等。微弧氧化(MAO)是一种广泛用于钛合金、镁合金和铝合金表面改性[7]的原位生成的高温高压等离子体电解氧化(PEO)技术。MAO是在钛基植入体上制备生物活性涂层最为有效、方便和经济的方法[8,9],具有以下独特优势。
首先,通过改变电解质中的浓度及组分可以获得组成、显微结构各不相同的MAO涂层。因此,该方法可应用于含有Ca、P元素的电解质中,在钛及其合金的表面制备具有高生物活性的钙磷酸盐氧化膜[9]。同时,可以向电解质中加入适当的Mn元素[10]或其他元素组分,用来制备具有优异生物性能的表面复合涂层。其次,MAO涂层中TiO2的多孔结构与放电电弧相关。涂层若存在大量微孔,则生物相容性高,可以有效地促进成骨细胞的黏附、增殖和分化,为骨组织提供向内生长的空间,从而有利于人体骨组织的修复[11-13]。最后,MAO技术是在基体表面原位生成涂层,具有表面结合强度高、耐腐蚀性好的优点,可以保证植入物在体内的长期安全性、稳定性[14]。
本文综述了电参数、电解液和添加剂等因素对MAO制备医用钛合金表面组成、结构以及生物性能的影响,归纳了MAO制备医用钛合金的相关问题,并对医用钛合金的发展提出了展望。
1、微弧氧化涂层的影响因素
1.1电参数
微弧氧化涂层的性能、微观结构和相组成受到多个参数的共同影响[15],包括施加电压、氧化处理时间、频率和占空比、电流密度等,通过优化各工艺参数可获得性能优异的涂层[16]。
1.1.1电压。
Huang等人[17]通过MAO技术在含钙磷酸盐的电解质中,以不同的电压制备了表面TiO2涂层(主要为锐钛矿和金红石结构),孔隙尺寸的大小与外加电压呈正比关系。与低电压下制备的样品相比,在高电压下制备的涂层与基材的黏结强度更高、耐磨性更强,并且在400和450V的较高电压下,均会形成新的CaTiO3相。

在模拟体液(SBF)中羟基磷灰石(HAP)的形成能力是涂层生物相容性的重要参考标准。在250~500V电压下,Song等人[18]测试了含Ca、P的生物复合涂层在SBF中生成钙磷酸盐的能力。在含C3H7Na2O6P·5H2O和(CH3COO)2Ca·H2O电解溶液中,采用MAO法在钛合金表面制备表面复合涂层。在电压为250V时,涂层主要由锐钛矿型TiO2组成;随着外加电压的不断增加,金红石相TiO2出现并逐渐增多,锐钛矿和金红石TiO2成为涂层的主要成分。电压低于350V时所制备表面的XRD衍射图谱中没有Ca、P所对应的衍射峰,说明在低电压下Ca、P元素不会镶嵌到涂层之中。含有Ca和P成分的表面复合涂层在SBF溶液中更容易生成HAP,具有良好的生物活性,可作为优秀的生物材料应用于医疗领域。施加电压的大小不同不仅影响涂层的黏结强度、耐磨性,也影响表面涂层的形状、相组成以及Ca和P含量,进而影响涂层的生物相容性。
1.1.2氧化时间。
MAO处理时间同样会对涂层的性能产生较大的影响。蔡倩等人[19]为增强钛合金表面的生物活性,在以磷酸盐为主要成分的电解液中对钛合金进行MAO表面处理。随着MAO氧化时间的增加,涂层中的金红石相TiO2逐渐减少,直至消失。同时表面孔径不均匀程度增加,粗糙度增大,有利于骨组织的生长,涂层的生物相容性能提升。徐林等人[20]对MAO氧化时间进行了更为具体的研究,涂层厚度和表面粗糙度随MAO时间的延长不断增加,为骨细胞提供了更多的生长空间,有利于促进成骨细胞的黏附、生长和繁殖。此外,氧化时间对涂层的微观结构和润湿性具有影响。其中,氧化时间为9min样品的表面能最高,涂层的润湿性最好,生物相容性大小与润湿性为正相关关系,该样品的存活细胞数量最多也印证了这一规律。合理控制氧化时间有利于骨细胞的迅速附着和增殖,降低感染的风险,提高涂层表面的生物活性。
1.1.3频率与占空比。
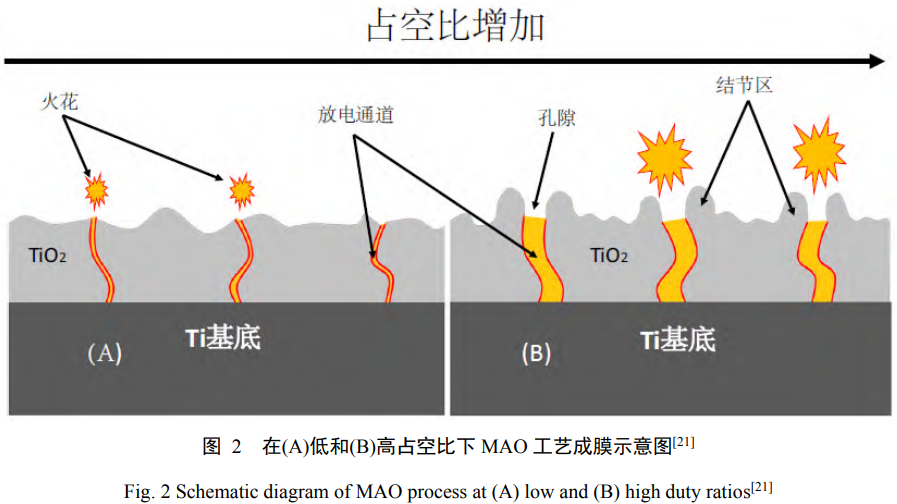
频率的大小控制着MAO单脉冲能量的输入,影响反应进程以及涂层表面的微观形貌,进而对MAO涂层的性能产生影响。在较低的频率下,制备的涂层表面粗糙、空隙较大。在电压和频率恒定时,随着占空比增加,单个周期中放电时间变长,电解液中的成分有更多的时间去黏结在钛合金表面形成涂层,从而使涂层的厚度增加,并且在涂层表面产生大量的孔洞,使表面粗糙度增加[21]。于晶等人[22]在Na2SiO3电解液体系中利用MAO工艺在钛合金表面制备了具有生物相容性的陶瓷层,研究不同脉冲频率下陶瓷膜的表面形貌、组成、微观摩擦磨损性能和耐蚀性能。随着脉冲频率的升高,涂层表面孔洞密集程度先增大后减小、平均孔径先减小后增大,且厚度逐渐减小。涂层在脉冲频率为700Hz具有最优的综合性能,表面平整、孔隙分布均匀,孔隙率达到最大值,平均孔径达到最小值,膜层耐磨性和耐蚀性较好,适合于更为复杂的工作环境。
1.1.4电流密度。
电流密度同样对涂层性能和微观组织形貌具有较大影响。涂层厚度随着电流密度的增加而增加,在涂层厚度增加的同时,表面粗糙度降低,微观形貌变得更加平整[23]。Shin等人[24]在碱性磷酸盐电解质中,研究了不同电流密度对表面性能和生物相容性的影响。发现电流密度增大,MAO涂层的表面孔径增大,锐钛矿相含量减少,但涂层的表面趋于光滑。通过改变MAO过程中的电流、电压、脉冲频率和氧化时间等参数来制备微弧氧化涂层,由于各个参数之间的相互影响,最优参数需要研究人员通过大量的实验获得,难以形成统一而系统的行业准则。
1.2电解液钛合金表面
MAO涂层的性能与电解液成分直接相关,电解液成分是决定MAO涂层微观结构和性能的最重要的因素。根据pH值,电解液可分为酸性电解液和碱性电解液两种。碱性电解液不仅对环境污染小、处理方便,而且在电场的作用下电解质成分可以进入涂层。因此,碱性电解液正在逐渐取代酸性电解液[25],并得到广泛应用。常用的电解液包括硅酸盐、磷酸盐和铝酸盐等电解液体系。
1.2.1硅酸盐电解质系统。
Na2SiO3是MAO处理中最合适的电解质成分之一,其特点是可在较宽的电解液温度和氧化电流范围内促进合金表面钝化,产生性能更好的含硅氧化膜[26],有利于MAO反应迅速进行。同时,所制备的MAO涂层具有高粗糙度、低表面附着力以及膜层厚等特点。因此,硅酸盐系统通常用于制备较厚的表面涂层。薛文斌等[27]研究人员使用8g/LNa2SiO3电解液,对Ti6Al4V合金进行MAO处理,使钛合金表面形成与基体结合牢固、厚度达50μm的涂层。该涂层主要由大量金红石型TiO2相、少量锐钛矿型TiO2相及SiO2非晶相组成,具有优良的耐磨性能。通过MAO工艺,Wang等人[28]分别选用硅酸盐电解液和磷酸钙的电解液,在Ti6Al4V合金表面制备复合涂层,用来优化钛合金表面的性能。以硅酸盐电解液制备的MAO涂层会在模拟体液(SBF)溶液中迅速膨胀和腐蚀,具有较差的耐腐蚀性;而在磷酸钙电解液中制备的MAO涂层在SBF溶液中比较稳定,具有优异的抗腐蚀性和表面稳定性,是一种具有良好生物相容性的医用生物材料,可用于骨植入物和牙科替代材料。
1.2.2磷酸盐电解质系统。
与硅酸盐电解液体系相比,在磷酸盐电解液中制备的复合涂层不仅表面更加平整、镀层更薄,而且涂层与基材的结合能力更强。在磷酸盐电解液中制备的MAO涂层主要由金红石型和锐钛矿型TiO2组成,涂层致密,并且具有优良的耐磨性和耐腐蚀性。Hong等人[29]以Ti6Al4V合金为基底,以不同浓度的柠檬酸、乙二胺和磷酸铵为电解质,将羟基磷灰石纳米颗粒均匀分散到电解质中,采用MAO工艺在钛合金表面同时制备出TiO2薄膜和HAP的复合涂层。该复合涂层具有良好的生物相容性、细胞附着能力和较高的表面结合强度,且结合强度不受TiO2薄膜厚度和形态的影响。杨瑞博[30]将Ca3(PO4)2、CaSiO3、Ca(OH)2和(CH3OO)2Ca·H2O四种不同钙盐分别加入到以K2HPO4·3H2O电解质的电解液中,研究不同种类的钙盐对MAO医用钛合金表面复合涂层的性能影响,发现K2HPO4·3H2O和CaSiO3体系对钛合金表面性能优化的效果最佳。此外,电解液中c(Ca)/c(P)值会直接影响涂层中Ca和P含量,进而会影响表面复合涂层的生物相容性;当电解液中的c(Ca)/c(P)值为1.67、电解液浓度为0.1mol/L时,所制备的涂层综合性能最佳,具有良好的生物相容性,可作为医用材料广泛应用。
1.2.3铝酸盐电解质系统。
由于形成的氧化铝硬度高、稳定性强,故可以推断在铝酸盐电解液中生成的复合涂层具有较高耐磨性。在铝酸盐溶液中采用MAO工艺在Ti6Al4V表面可以制备出较厚的陶瓷氧化膜[31]。该涂层主要由金红石型TiO2和TiAl2O5化合物组成,且具有良好的耐磨性能。在含有NaAlO2成分电解液中,采用MAO法在纯Ti的表面制备涂层[32],铝酸钠的浓度会直接影响涂层的性能和表面形态。随着NaAlO2浓度的增加,涂层上TiO2相含量降低,涂层的耐腐蚀性先上升后下降。同时,涂层表面变得粗糙,但其表面的微孔数量减少,孔径变大。然而,由于铝酸盐稳定性差且易水解,故制备的工艺较为困难,其应用也受到了一定的限制。由于人骨中的钙磷含量较高且有固定比例,可在磷酸盐体系中添加适当钙盐以获得相同的组分,增强复合涂层的力学性能和耐蚀性,同时提高涂层表面的生物相容性,因此含钙盐的磷酸盐体系电解液常用于制备医用钛合金生物材料。
1.3添加剂对MAO涂层的影响
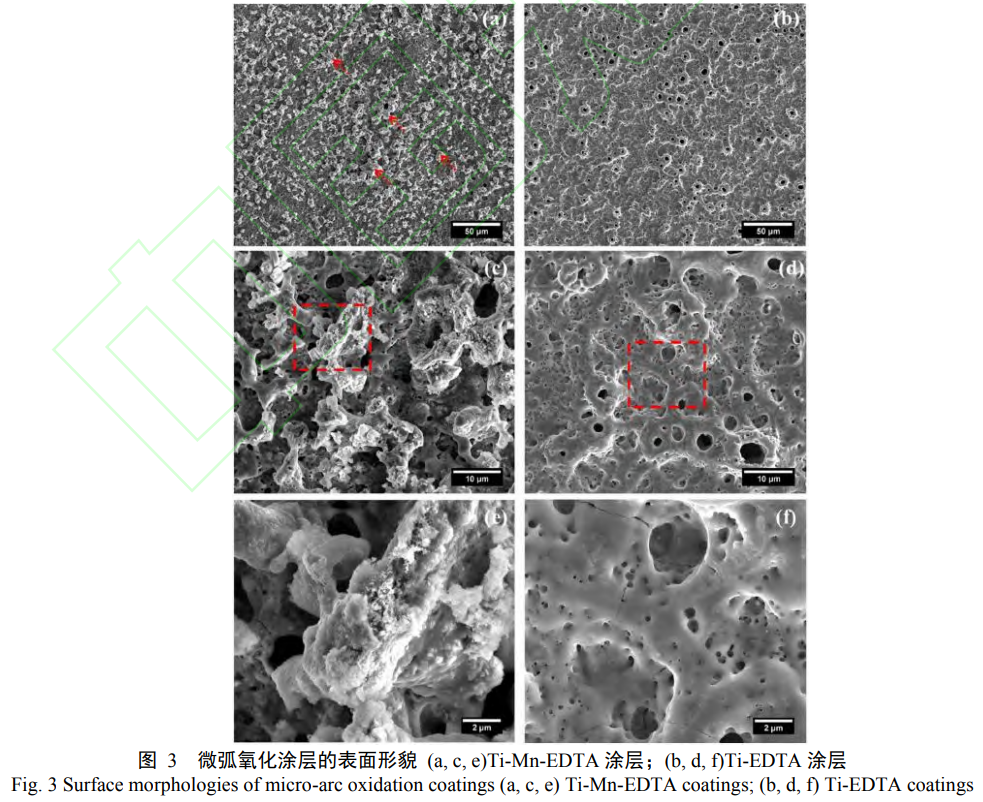
随着科技的进步和人们对健康的关注度不断提高,对医用钛合金的性能提出了新的要求。为了得到性能更加优异的医用钛合金,研究人员向电解液中添加不同的金属元素作为添加剂,以优化涂层的性能,便于应对不同的应用环境[33,34]。Zhang[35]利用醋酸钙、醋酸锌、β-甘油磷酸二钠、直径小于20nm的银纳米粒子和十二烷基苯磺酸钠五种物质组成电解液,在纯钛表面上经2minMAO处理,制备出由无定形锐钛矿相TiO2、金红石相TiO2、ZnO、Zn2TiO4和均匀分布的Ag纳米颗粒共同组成的涂层。在模拟体液溶液中,涂层中Zn、Ag元素的释放期长达36周,具有持久的抗菌性能。与抛光的纯钛相比,掺杂Zn元素和Ag纳米粒子的涂层可以显著抑制金黄色葡萄球菌在培养液表面的附着,减少培养液中浮游细菌的数量,具有优异的抗菌性,并且对人体无危害,这表明Zn和Ag共掺杂的TiO2是一种具有持久抗菌性能和生物相容性的涂层。Liu等人[36]利用MAO方法制备具有生物活性的含锰表面复合涂层,经分析得出Mn被成功地引入到MAO涂层中,涂层主要由锐钛矿TiO2、金红石TiO2和钛构成。在MAO涂层中加入锰会形成多孔的三维形貌,为骨组织提供了生长空间,有利于骨细胞在钛合金表面附着和生长。在成骨细胞的培养中,含MnMAO涂层具有比标准MAO涂层具有更高的骨细胞附着能力。因此,含MnMAO涂层具有优异的生物相容性,更有利于成骨细胞的修复,有广阔的应用前景。张欣欣等人[37]采用一步MAO法以Na2Mn-EDTA为添加剂制备了含Mn的Ca-P/TiO2复合涂层,当Na2Mn-EDTA浓度达到0.02mol/L时,含Mn复合涂层才会形成Ca-P相,并且可能会伴随HAP相的产生,这与EDTA配合物和Mn的共同作用有关。含Mn的TiO2涂层是由两部分组成:锰含量较高的外层和锰含量相对较低的内层。含Mn的Ca-P/TiO2复合涂层能有效促进骨细胞的附着与生长,并具有抑制金黄色葡萄球菌生长的功能。因此,在含有Na2Mn-EDTA的电解液中,采用一步MAO法可以制备出具有优异成骨性能的表面复合涂层。
1.4应用
1.4.1口腔方面。
钛和钛合金是目前口腔种植义齿修复的重要选择材料,但由于摩擦性能差、表面生物活性低等特点,直接植入人体存在潜在的不利影响,通过表面改性在钛合金表面形成涂层,以促进骨生长、骨结合、抗感染等问题很有研究价值,很大程度上可以改善这种局面,目前在钛合金表面进行微弧氧化和涂覆抗菌大分子物质都取得了一定的进展[38,39]。根据长期系统的临床研究评价,种植牙在10年中的成活率和成功率超过95%[40]。由钛合金制成的正畸牙套表现出优良的性能,使牙齿能够实现高精度移动,从而矫正牙齿。
1.4.2骨骼方面。
钛的特性能够满足肌肉骨骼系统的复杂需求,使得与骨骼无缝结合的植入物的开发成为可能[41],从而改善了人们的活动能力和生活质量。钛可用于各种关节植入物,如肩部、肘部、手腕、髋关节、膝关节和踝关节。虽然钛表现出卓越的生物相容性、强度和耐腐蚀性,但其在磨损和摩擦腐蚀[42]方面的性能有限。由于在运动过程中关节处直接接触并相互摩擦,钛在这些植入物中使用的一个独特方面是它从未被用作“关节组件”。然而,钛在骨科中可作为关节植入物内“承重部件”的材料选择。承重组件的目的是提供稳定性和支撑性,将机械负载从植入物传递到周围的骨骼,从而减轻对植入体的负载,钛的柔韧性、强度和轻质的独特性质特别有利作为承重件。
2、结语
MAO作为对材料进行表面处理的一种重要方式,拥有许多优点,原位生成的涂层与基体结合强度更高,硬度高,耐磨耐腐蚀性能好,处理效率高。电压、氧化时间、频率、占空比和电流密度均对微弧氧化表面膜层结构产生重要影响,微观结构制备的最佳条件需要电参数优化组合。电解液成分决定MAO涂层的表面性能,含钙磷酸盐电解液制备的表面膜层生物相容性优良。钛合金生物医用材料的发展同时也具有以下局限性,有待于进一步研究:
(1)当前大多数研究主要集中在单一因素上,缺乏对综合因素的系统研究;
(2)研制高效且能稳定使用的电解液是要解决的一大难题,温度变化对电解液性能影响较高;
(3)对于镶嵌到涂层中的各种添加剂,是否会对人体产生危害有待于进一步研究。随着人们的健康意识水平的提高,医疗制造行业领域会受到更多关注。进一步发掘医用钛合金的潜能,符合时代发展的需求。同时,也有利于材料学与医学交叉融合,促进二者的共同发展。
参考文献
[1] LIMA G G, SOUZA G B, LEPIENSKI C M, et al. Mechanical properties of anodic titanium films containing ions of Ca and P submitted to heat and hydrothermal treatment[J]. Journal of the Mechanical Behavior of Bio-medical Materials, 2016, 64: 18-30.
[2] LEI Z, ZHANG H, ZHANG E, et al. Antibacterial activities and bio-compatibilities of Ti-Ag alloys prepared by spark plasma sintering and acid etching[J]. Materials Science and Engineering: C, 2018, 92: 121-131.
[3] 顾艳红, 马慧娟, 陈玲玲, 等. Ti6Al4V 钛合金超声波冷锻/微弧氧化涂层的制备及耐磨性能[J]. 中国表面工程, 2016, 29(1): 87-95.
[4] AZZOUZ I, KHLIFI K, FAURE J, et al. Mechanical behavior and corrosion resistance of sol-gel derived 45S5 bioactive glass coating on Ti6Al4V synthesized by electrophoretic deposition[J]. Journal of the Mechanical Behavior of Bio-medical Materials, 2022, 134: 105352.
[5] GAO Y, SHEN K, WANG X. Microstructural evolution of low-pressure plasma-sprayed Ti-6Al-4V coatings after heat treatment[J]. Surface and Coatings Technology, 2020, 393: 125792.
[6] KORKMAZ K. The effect of Micro-arc oxidation treatment on the microstructure and properties of open cell Ti6Al4V alloy foams[J]. Surface and Coatings Technology, 2015, 272: 72-78.
[7] QI X, JIANG B, SONG R. Effects of ageing treatment on corrosion behavior of 7075 aluminum alloy coated by micro arc oxidation (MAO)[J]. Corrosion Science, 2022, 199: 110164.
[8] LI G Q, MA F C, LIU P, et al. Review of micro-arc oxidation of titanium alloys: Mechanism, properties and applications[J]. Journal of Alloys and Compounds,2023, 948:169773.
[9] ZHANG R, LIU X, XIONG Z, et al. Novel micro/nanostructured TiO2/ZnO coating with antibacterial capacity and cytocompatibility[J]. Ceramics International, 2018, 44(8): 9711-9719.
[10] KANG J I, SON M K, CHOE H C, et al. Bone-like apatite formation on manganese-hydroxyapatite coating formed on Ti6Al4V alloy by plasma electrolytic oxidation[J]. Thin Solid Films, 2016, 620: 126-131.
[11] CHEN H, WANG C, YANG X, et al. Construction of surface HA/TiO2 coating on porous titanium scaffolds and its preliminary biological evaluation[J]. Materials Science and Engineering: C, 2017, 70(2): 1047-1056.
[12] DURDU S, USTA M, BERKEM A S. Bioactive coatings on Ti6Al4V alloy formed by plasma electrolytic oxidation[J]. Surface and Coatings Technology, 2016, 301: 85-93.
[13] JIN M, YAO S, WANG L N, et al. Enhanced bond strength and bio-activity of interconnected 3D TiO2 nano-porous layer on titanium implants[J]. Surface and Coatings Technology, 2016, 304: 459-467.
[14] ALVES A C, COSTA A I, TOPTAN F, et al. Effect of bio-functional MAO layers on the electrochemical behaviour of highly porous Ti[J]. Surface and Coatings Technology, 2020, 386: 125487.
[15] PESODE P, BARVE S. Surface modification of titanium and titanium alloy by plasma electrolytic oxidation process for biomedical applications: A review[J]. Materials Today: Proceedings, 2021, 46: 594-602.
[16] FATTAH-ALHOSSEINI A, MOLAEI M, BABAEI K. The effects of nano- and micro-particles on properties of plasma electrolytic oxidation (PEO) coatings applied on titanium substrates: A review[J]. Surfaces and Interfaces, 2020, 21: 100659.
[17] HUANG P, WANG F, XU K, et al. Mechanical properties of titania prepared by plasma electrolytic oxidation at different voltages[J]. Surface and Coatings Technology, 2007, 201: 5168-5171.
[18] SONG W H, JUN Y K, HAN Y, et al. Biomimetic apatite coatings on micro-arc oxidized titania[J]. Biomaterials, 2004, 25: 3341- 3349.
[19] 蔡倩, 李玉海, 卢世松. 氧化时间对钛合金微弧氧化膜层的影响[J]. 沈阳理工大学学报, 2014, 33(3): 45-48.
[20] XU L, WU C, LEI X, et al. Effect of oxidation time on cyto-compatibility of ultrafine-grained pure Ti in micro-arc oxidationtreatment[J]. Surface and Coatings Technology, 2018, 342: 12-22.
[21] TORRES-CERON D A, RESTREPO-PARRA E, ACOSTA-MEDINA C D, et al. Study of duty cycle influence on the band gap energy of TiO2/P coatings obtained by PEO process[J]. Surface and Coatings Technology, 2019, 375: 221-228.
[22] 于晶, 吴连波, 马维红. 脉冲频率对医用钛合金微弧氧化膜微观结构和性能的影响[J]. 稀有金属材料与工程, 2015, 44(3): 692-696.
[23] YANG Y, WU H. Effects of current density on microstructure of titania coatings by micro-arc oxidation[J]. Journal of Materials Science & Technology, 2012, 28(4): 321-324.
[24] SHIN K R, KIM Y S, YANG H W, et al. In vitro biological response to the oxide layer in pure titanium formed at different current densities by plasma electrolytic oxidation[J]. Applied Surface Science, 2014, 314: 221-227.
[25] ZHANG R F. Film formation in the second step of micro-arc oxidation on magnesium alloys[J]. Corrosion Science, 2010, 52(4): 1285-1290.
[26] 姜大鹏, 张昆, 张丽伟. 时间对微弧氧化膜性能的影响[J]. 长春工业大学学报:自然科学版, 2013, 34(3): 253-256.
[27] 薛文斌, 邓志威, 陈如意, 等. 钛合金在硅酸盐溶液中微弧氧化陶瓷膜的组织结构[J]. 金属热处理, 2000(2): 5-7.
[28] WANG J, PAN Y, FENG R, et al. Effect of electrolyte composition on the microstructure and bio-corrosion behavior of microarc oxidized coatings on biomedical Ti6Al4V alloy[J]. Journal of Materials Research and Technology, 2020, 9(2): 1477-1490.
[29] HONG M H, LEE D H, KIM K M, et al. Study on bioactivity and bonding strength between Ti alloy substrate and TiO2 film by micro-arc oxidation[J]. Thin Solid Films, 2011, 519(20): 7065-7070.
[30] 杨瑞博. 钛合金表面微弧氧化生物活性涂层研究[D]. 西安: 长安大学, 2013.
[31] XUE W, WANG C, CHEN R, et al. Structure and properties characterization of ceramic coatings produced on Ti6Al4V alloy by microarc oxidation in aluminate solution[J]. Materials Letters, 2002, 52(6): 435-441.
[32] WANG P, WU T, PENG H, et al. Effect of NaAlO2 concentrations on the properties of micro-arc oxidation coatings on pure titanium[J]. Materials Letters, 2016, 170: 171-174.
[33] ROŚCISZEWSKA M, SHIMABUKURO M, RONOWSKA A, et al. Enhanced bioactivity and mechanical properties of siliconinfused titanium oxide coatings formed by micro-arc oxidation on selective laser melted Ti13Nb13Zr alloy[J], Ceramics International, 2024, 50: 43979-43993.
[34] NISAR S S, ARUN S, TOAN N K, et al. Formation of Ca, P, and Zn-doped ZrO2/TiO2 coating layer via plasma electrolytic oxidation and magnetic sputtering: Improving surface characteristics and biocompatibility of Ti-6Al-4V alloy[J], Journal of Materials Research and Technology, 2024, 31: 1282-1303.
[35] ZHANG L, GAO Q, HAN Y. Zn and Ag co-doped anti-microbial TiO2 coatings on Ti by micro-arc oxidation[J]. Journal of Materials Science & Technology, 2016, 32: 919-924.
[36] LIU Y-T, KUNG K-C, LEE T-M, et al. Enhancing biological properties of porous coatings through the incorporation of manganese[J]. Journal of Alloys and Compounds, 2013, 581: 459-467.
[37] ZHANG X, LV Y, FU S, et al. Synthesis, microstructure, anti-corrosion property and biological performances of Mn-incorporated Ca-P/TiO2 composite coating fabricated via micro-arc oxidation[J]. Materials Science and Engineering: C, 2020, 117: 111321.
[38] 王月升,高炜,彭诚. 口腔种植体材料表面处理及其抗菌、诱导成骨的能力[J]. 中国组织工程研究, 2023, 27: 1961-1968.
[39] WANG M, LI J, GENG M, et al. Mussel-inspired bifunctional coating for long-term stability of oral implants[J]. Acta Biomaterialia, 2024, 188: 138-156.
[40] SALES P H H, BARROS A W P, OLIVEIRA-NETO O B D O, et al. Do zirconia dental implants present better clinical results than titanium dental implants: A systematic review and meta-analysis[J]. Journal of Stomatolgy, Oral and Maxillofacial Surgery, 2023, 124: 101324.
[41] CASTAGNINI F, BORDINI B, STEA S, et al. Highly porous titanium cup in cementless total hip arthroplasty: registry results at eight years[J]. International Orthopaedics, 2019, 43: 1815-1821.
[42] HACISALIHOGLU I, SAMANCIOGLU A, YILDIZ F, et al. Tribocorrosion properties of different type titanium alloys in simulated body fluid[J]. Wear, 2015, 332-333: 679-686.



jhx-ti.com
聚宏信微信二维码