随着全球老龄化人口的增加以及意外事故导致骨损失的案例越来越多,全球骨修复市场需求正大幅增加[1]。为了改善患者生活质量,外科手术中常采用人工植入物,以替换患者失效部位。临床上常用的金属植入材料一般包括钛合金、不锈钢以及钴铬合金等,主要作为人工关节、骨代替物等,替换患者受损或病变的硬质组织。
不锈钢是发展较早,材料成本较低的金属医用植入材料,曾占据了较大部分的医用金属植入物市场。但由于不锈钢的密度较大,患者异物感强,且 Fe 的耐蚀性较差,使用过程中磨损释放的 Ni、Cr 离子对细胞毒副作用大等因素,其在植入体市场上的应用规模在不断缩小。随着生物医用合金的更新发展,具有更好生物相容性的钛及钛合金产品近年来被广泛的应用于骨组织修复上[2]。

目前,绝大多数医用金属骨植入市场的产品仍采用模具铸造的生产加工方式。此类方法对产品尺寸区分度较小,无法满足不同人种、性别、年龄及个体病例的个性化需求。同时,金属材料的弹性模量比骨大,其与骨结合使用可能会产生“应力屏蔽”现象,长期使用则会导致病患处出现骨质疏松,甚至引起植入体滑落,导致种植失败。因此,近年来,研究者们试图利用多孔材料降低植入体弹性模量,提高植入体成功率。传统的多孔材料制备方法包括粉末冶金法[3,4],浆料法[5,6]和纤维烧结法[7-9]等,但均因其技术特点,或多或少的影响材料力学性能或生物学性能,使其无法满足植入体的各项需求,导致多孔生物植入体发展较为缓慢。
随着 3D 打印装备技术的不断发展,利用 3D 打印技术制造医用多孔材料的优势越发明显。3D 打印技术拥有极高的加工自由度,对于骨科材料的 3D 打印,其可以利用 CT、MRI 等医学影像,通过计算机重建患者失效骨模型,制造出生物学性能与力学性能更与骨匹配的植入物产品[10,11],更可以针对每位患者制定独特的治疗方案,实现为骨植入患者“量体裁衣”的产品定制。3D 打印因为其层层加工的特点,可以方便的制造出各种孔型尺寸及具有仿生学效应和生物相容性的多孔材料,提高植入物的骨结合能力[10]。因此,3D
打印在医用领域存在巨大的应用潜力。本文将主要介绍 3D 打印技术及其近年来在医用多孔钛合金研究上的应用进展。
1、 医用钛合金的种类及其应用情况
钛及钛合金,是 20 世纪中期才逐渐开始发展起来的一种金属材料。其拥有密度低,比强度高,耐蚀性能好,生物相容性好等特点,被广泛应用于航空航天、石油化工和医疗健康领域。对于钛在医疗植入上的应用,早在 1940 年,就有学者报道了钛植入物与小鼠股骨之间的惰性表现[12]。1951 年,又有学者进一步证实了纯钛相比其他传统植入物材料,拥有更好的的生物相容性能[13]。但由于当时钛合金生产成本高昂,不锈钢在植入体市场已较成熟等原因,钛合金在医学领域的应用发展一直较为缓慢[14]。
自 20 世纪 60 年代,纯钛开始作为人体植入物被应用于临床口腔研究[15]。随着具有更加优异使用性能的 Ti-6Al-4V 合金的开发,钛合金开始被广泛应用于医用植入 物市 场。虽 然 Ti-6Al-4V 的 弹性模 量仅 为114 GPa 左右,较不锈钢、钴铬合金等其他生物材料低,但仍比人体皮质骨(15~25 GPa)[16]和松质骨(0.05~3 GPa)[17]高出一个数量级。如此大的差异会导致所谓的“应力屏蔽”效应发生,长期将会导致植入体周围骨吸收,甚至导致植入体的滑落,降低骨植入的成功率。
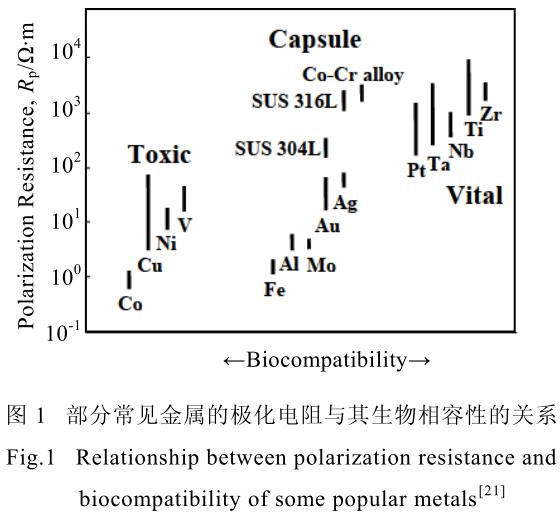
同时,其成分中所包含的 Al、V 等元素,均具有一定的生物毒性,长期在人体内使用会引起植入体周围组织病变[18,19],诱发脑病、贫血等症状[20],并不适合长期在人体内使用。图 1[21]展示了元素生物相容性与极化电阻的关系。近年来,针对生物用钛合金,研究学者围绕无毒、低弹性模量等特性,开发了诸如含有Ti-Nb-Ta-Zr 的 Gum 合金、含有 Ti-Nb-Zr-Mo-Sn 的 TLM合金以及含有 Ti-Nb-Zr-Sn 的 Ti2448 合金等等,这些合金均采用了生物相容性较好的 Nb、Zr、Mo 等元素。

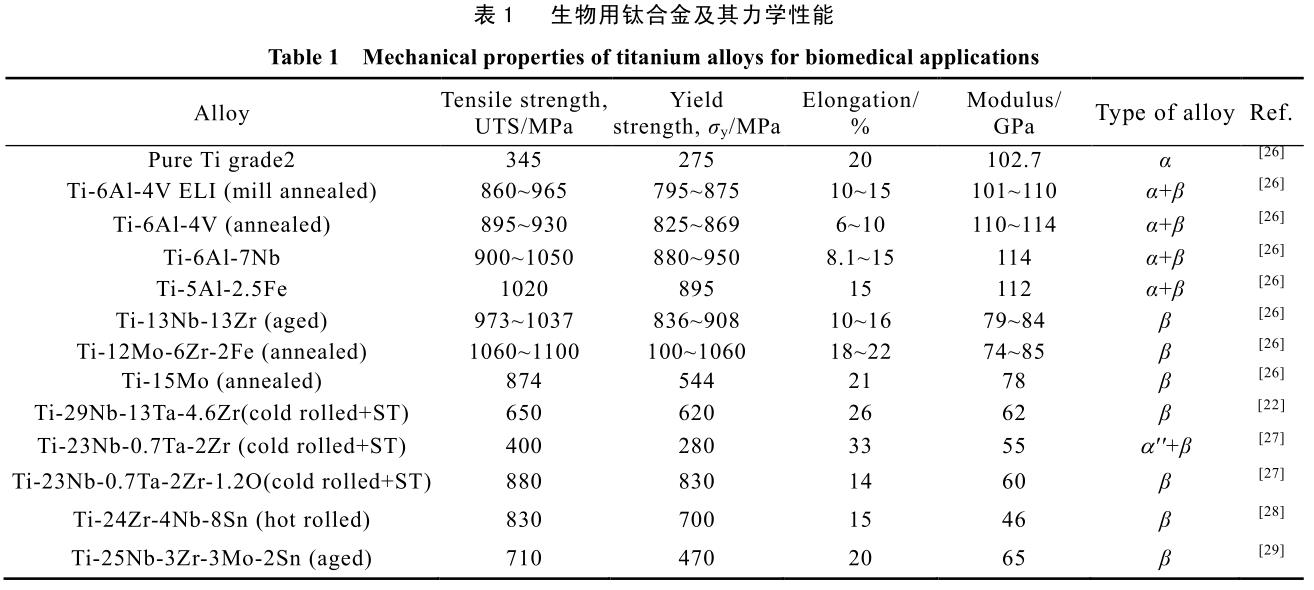
有实验结果表明,此类钛合金的骨促进性、致敏性等生物学表现均优于传统植入物所采用的 Ti-6Al-4V 与Ti-6Al-7Nb[22-25]。表 1 总结了近年发表在各文献中的生物用钛合金的合金成分及其主要力学性能。
2 、多孔钛合金制备与 3D 打印技术
钛及钛合金因为其良好的生物相容性、耐蚀性和力学性能,被广泛的应用于骨组织修复。虽然钛合金的弹性模量比不锈钢或 Co-Cr 合金低,但传统加工方法制造生产的致密钛合金材料仍拥有较高的弹性模量。有研究数据表明,多孔材料的开发可有效地降低弹性模量,且为骨长入提供物理空间[30],增强骨固定。
对于骨植入多孔材料,有学者报道,其孔隙率应控制在 65%~80%之间[31,32]。对于孔隙率过大的植入体材料,孔隙率会显著降低材料的抗压强度与疲劳性能,几乎无法满足材料的正常使用需求;而低于这一值的多孔材料,由于致密度较高,影响骨组织长入材料内部,降低植入体与材料的结合强度。
为达到上述材料孔隙率的设计需求,传统的多孔钛合金材料制备方法主要包括如:粉末冶金法[3,4],浆料法[5,6]和纤维烧结法[7-9]等。但此类方法制作的多孔材料普遍孔径较小,孔隙分布不均匀,通孔率不高,或孔壁结构上存在大量微孔,限制了其在生物材料领域的进一步发展。近年来,随着“3D 打印”技术的提出,因其加工的特点,用 3D 打印来制造多孔材料的优势越发明显。表2 对比了几种常见多孔材料制备方法的特点,图 2 则展示了几种常见多孔材料制备方法制备的多孔材料[6,9,33]。
3D 打印这一概念最早由美国学者于 20 世纪 80年代提出[34]。美国材料与试验协会 ASTM 将增材制造或 3D 打印定义为“利用三维数据,通过层层相叠加结合的一种制作工艺”,拥有极高的加工自由度。但受限制于 3D 打印设备的发展,该技术在近十几年才在生物材料应用研究制造方面有了较为迅猛的发展。


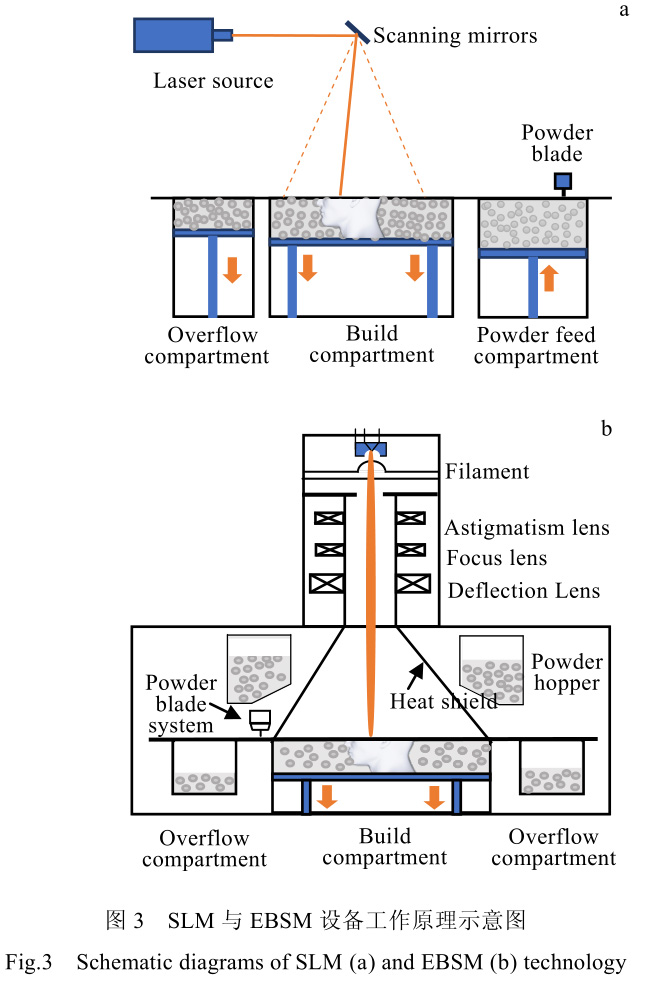
3D 打印设备,按照其供料方式、能量源等,可以分为近十种类别。对于包括医用零件、小型航空航天零件的增材制造,现阶段最为流行的打印制备方法包括激光选区熔化(selective laser melting, SLM)与电子束熔化(electron beam selective melting, EBSM)两种[35,36]。此类方法可加工的零件尺寸一般小于 0.5 m,加工精度与成形质量较高。对于其中的 SLM 工艺,其是利用激光功率在 200~600 W 之间的激光束作为能量源,通过阵镜偏转,激光束选择性的将指定区域金属粉末逐层熔化凝固在一起,实现“三维打印”的目标。此方法制造出的金属材料致密度很高,力学性能甚至可优于传统铸造方法加工的零件[37]。EBSM 工艺的工作原理在加工方式上与 SLM 工艺较为相似,但在能量源上采用更高能的电子束来代替激光。其利用偏转线圈对射出的电子方向进行控制,选择性的照射到粉床表面,使电子束入射位置附近的粉末熔化并逐层凝固在一起。
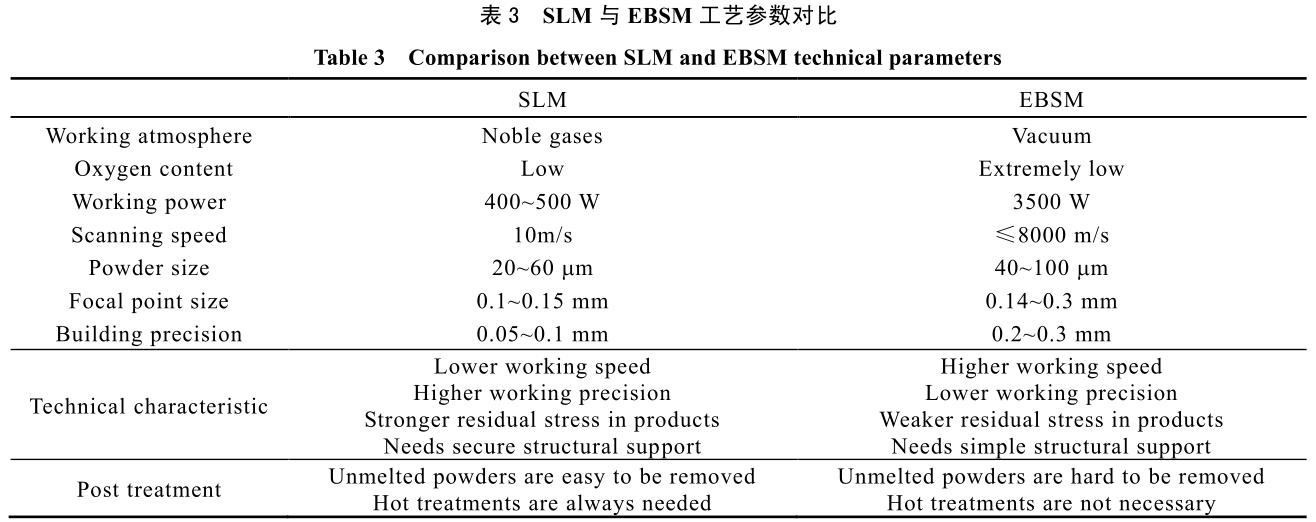
其常见电子束功率从 2 kW 至数十 kW,较激光能量高很多。因此,EBSM 方法对比 SLM 方法,具有加工速度快,但精度相对较低的特点。目前两者都是金属材料增材制造的最常见技术,其工作原理示意图见图 3。表 3 中则总结了两种工艺参数等对比数据。
3、 3D 打印多孔钛合金现状
3.1 3D 打印医用钛合金植入体
纵观国内外植入体市场,传统的生产厂商主要包括 Stryker,Zimmer-Biomet,爱康医疗,威高骨科等。
其过往产品设计思路,往往根据统计大数据,设计生产一系列特定尺寸的植入体产品。对于个体差异较明显或骨缺损较为特殊的部位,此类固定设计基本无法满足各人种、性别、年龄阶段的多样化需求。对于骨损失部位较大或较特殊的患者,传统的治疗方案常包括要求患者面临“削足适履”的窘境,加大手术风险与患者痛苦。随着 3D 打印技术的发展,植入体的设计与生产部门的工程师们,可以根据病患的 CT 与 MRI等医学影像,利用电脑软件,重建患者的骨 3D 模型。再通过 3D 打印加工方法,轻松实现各种不同规格的
植入体生产,实施对患者进行“量体裁衣”的治疗方案。面对全球人口老龄化的现状以及人们对精准医疗的盼望与需求,3D 打印制造植入体的治疗方案的优势不容小视。
近年来,随着 3D 打印设备价格不断降低,3D 打印在医疗行业的应用逐渐扩大。许多研究机构与传统医疗器械生产企业均已着力于 3D 打印医疗产品的研发与制造。利用 3D 打印制作了诸如牙冠、髋臼杯、椎间融合器等一系列植入物材料。2010 年,美国Exactech 公司的 3D 打印骨科植入体率先获得了美国食品药品管理局 FDA 的认证。我国的爱康医疗则于2015 年获得首张中国国家食品药品监督管理总局CFDA 颁发的 3D 打印植入物产品认证,打开了 3D 打印植入物市场商业化应用的大门。FDA 与 2017 年 12月发布了 3D 打印医疗器械技术指南,进一步规范了3D 打印医用植入体的生产与检测标准,为医疗器械厂商 3D 打印产品快速获得 FDA 认证铺平了道路。
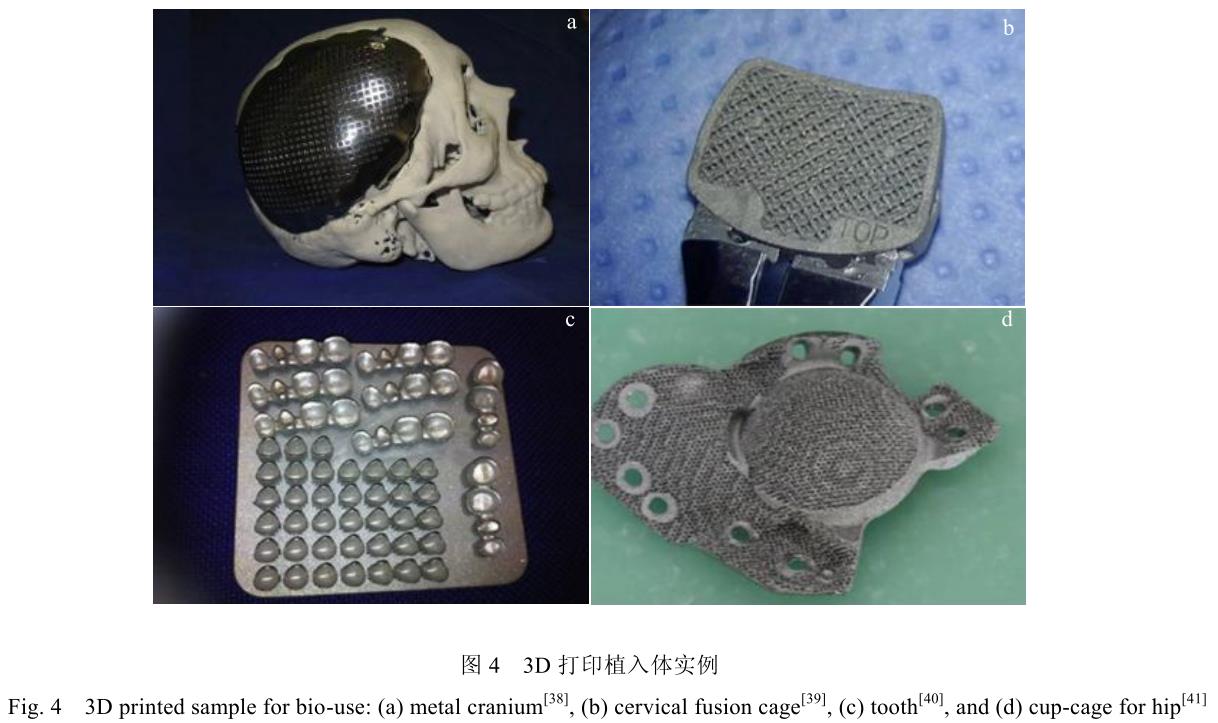
图 4 展示了部分利用 3D 打印方法设计钛合金植入材料改善患者手术方案的案例[38-41]。但由于 3D 打印制造加工过程不完全等同于传统材料的加工方法,其制造零件的组织形态、力学性能与生物学性能等,仍需要研究者重新评估与考量。
3.2 3D 打印钛合金植入体可加工性能研究
金属植入材料具有力学强度要求高,外观形状复杂等特点。传统金属植入物常采用铸造方法进行生产加工。由于 3D 打印特殊的加工方法,要求 3D 打印材料具有较高的能量吸收率与可焊性,材料的可加工性值得研究。3D 打印产品的力学性能与表面质量,主要取决于打印功率与扫描策略的配合。对于早期的 3D打印加工,因为其机器的局限性,加工能量源输出功率不稳定,加工功率与扫描速度的配合不佳等原因,导致加工出的产品粉末熔化不完全,孔隙严重,致密度与力学强度均低于传统铸件。Abe 等人[42]曾在 2003年,利用 SLM 技术,采用平均粉末粒径为 25 µm 的纯钛粉,以研究加工材料的致密度问题。然而,由于机器功率、扫描策略等问题,其得到了致密度仅约为92%的产品。
随着近些年 3D 打印设备的不断发展,Attar 等人[43]在 2014 年使用相近化学组成的原料和平均粉末粒径更粗的纯钛粉(50 µm)(表 4),研究了不同打印参数设置对打印致密性的影响。如图 5,其采用 3 种不同打印参数,得到致密度分别为 96.3% (P=85 W, v=71 mm/s)、98.7% (P=135 W, v=112 mm/s) 与 99.5% (P=165 W, v=138 mm/s)的纯钛零件,其致密度可达到传统铸件水平。对于增材制造材料的力学性能,多篇文献指出,采用 SLM 及 EBSM 方法制造钛及钛合金产品,其耐磨性[44],显微硬度、抗压强度、抗拉强度[43,45] 等性能,均优于传统铸造材料。虽然 Edwards 等人[46]也在其文献中提出,因 SLM 加工仓体温度近似于室温温度,温度梯度大,加工冷却速度较快,经 SLM 加工后
的材料内部残余应力来不及释放,导致其抗疲劳强度略低于传统锻件。但 Mercelis 等人[47]在对 SLM 加工后的材料进行后续热处理后,可有效去除残余应力,进而改善其力学性能。因此利用 3D 打印技术改善现有医用钛合金植入物制造工艺,较为可行。

3.3 3D 打印钛合金植入体显微组织研究
金属材料的显微组织对材料的力学性能影响较大。3D 打印过程中,由于材料的加热与冷却速率与传统加工方法差异较大,导致 3D 打印金属材料显微组织与传统铸造、锻造后的显微组织有明显差异。例如,在利用 SLM 方法打印钛合金零件的过程中,由于冷却温度梯度大,冷却速率较高,在钛合金的凝固过程中,钛合金的相转变为相的过程来不及进行,导致凝固组织中形成大量过饱和的针状马氏体′[48,49]。且马氏体尺寸与冷却速率密切相关,当冷却速率越高时,马氏体的尺寸越细 [50]。因此,对比于其他传统加工方法,3D 打印零件具有抗拉性能较高,延展性较差的特点。相比于 SLM 加工工艺,由于 EBSM 工艺加工过程中,基板温度始终维持在较高温度,且真空环境下,零件冷却速度较慢,EBSM方法加工生产的钛合金零件相比 SLM 方法加工的钛合金零件,合金中的组织更为粗大,抗拉性能较低,延展性能更好。
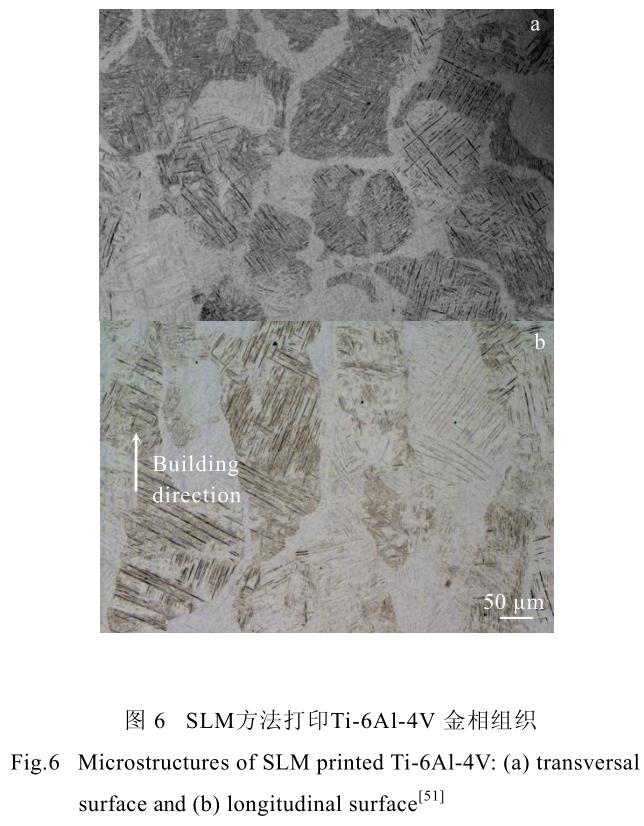
同时,沿建造方向生长的柱状晶也是 3D 打印钛合金及其他金属材料的一个显著特点。由于 3D 打印过程中,激光或电子束的能量较高,产生一定厚度的热影响区,导致熔池深度超过粉末层厚度。此热影响区会导致之前已经凝固的零件表面重新熔化凝固,在零件建造方向上累加形成较为粗大的柱状晶[51],导致 3D打印零件各向异性明显。图 6 展示了 SLM 方法打印Ti-6Al-4V 合金横纵截面的金相图。图中可明显观察到上述的针状马氏体相及沿建造方向生长的柱状晶。
在图 6 中,除了可以观察到较为明显的柱状晶外,还可以较为清楚的观察到左右斜向交错的针状马氏体组织。通过分析其形态与形成机理,研究者们发现,该针状马氏体组织的倾斜方向与局部热传导方向密切相关,即与激光束或电子束的扫描方向密切相关。当激光束或电子束自左向右扫描时,晶格倾斜方向为“///”;而当激光束或电子束自右向左扫描时,晶格倾斜方向为“\\\”[48]。
此类特殊的显微组织导致 3D 打印钛合金材料具有明显的各向异性,且此各向异性与 3D 打印加工过程中制定的加工扫描策略密切相关。因此,根据材料的种类及零件的用途,制定适当的 3D 打印加工策略,在 3D 打印加工零件的显微组织与原始力学性能方面显得尤为重要。
3.4 3D 打印多孔钛合金植入体力学性能研究
“应力屏蔽”效应是生物材料学家在材料设计及加工过程中,常提到的一点问题。其是指生物植入体弹性模量(>100 GPa)与受体骨弹性模量(<20 GPa)的数值差异较大,导致植入体受力后变形程度与骨不一致,长期使用会引起植入体周围骨质疏松与骨消融,最终导致植入体滑落的现象。适当降低弹性模量的方法是近年来生物材料研究学者的工作重点之一。通常,降低弹性模量的方法包括采用弹性模量较低的合金或利用多孔设计降低其零件强度。
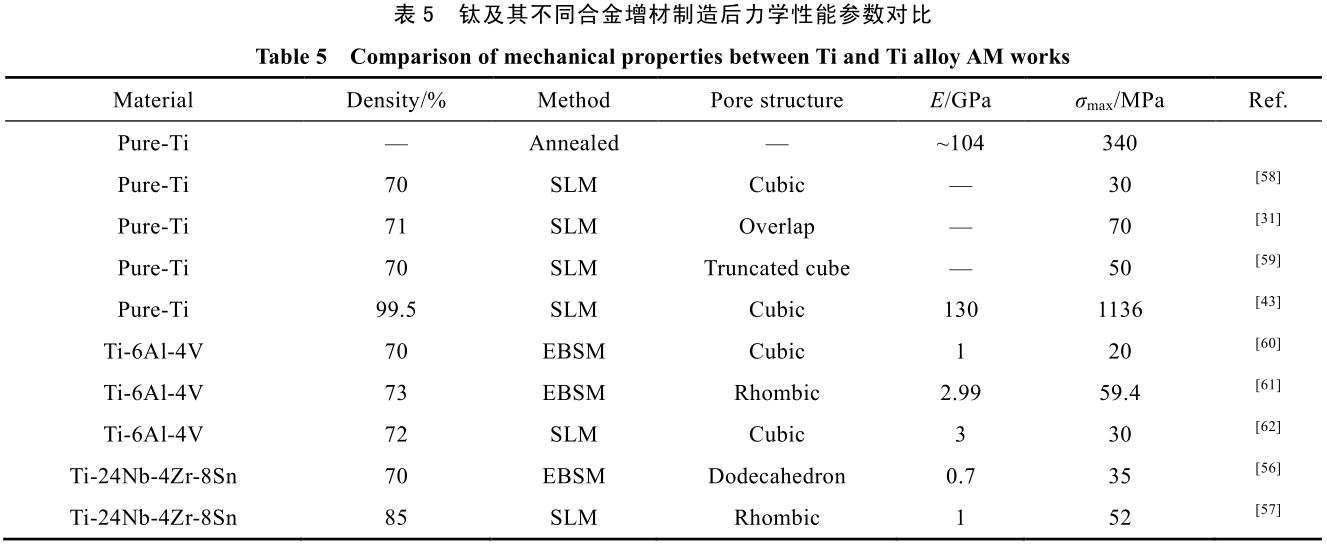
由于 3D 打印的加工方式可以简便的实现毫米级多孔材料的设计,且其加工形状并不受传统加工方式的限制,是近年来最好的生物多孔材料的设计加工方法。表 5 展示了部分典型钛及钛合金增材制造方法制得的多孔部件的原料加工方式和力学性能等相关数据。
由表 5 可以看出,虽然多孔结构设计可以有效降低材料的弹性模量,但其抗压强度等也会随之大幅降低。Stamp 等人[31]曾提出,为达到骨组织长入等目的,植入材料孔隙率应大于 65%,弹性模量应低于 3 GPa,且抗压强度同时不能低于 50 MPa。参照表 5 中的相关文献可以发现,由于合金本身弹性模量与抗压强度的关系,采用纯钛或 Ti-6Al-4V 等传统增材制造合金基本无法同时满足上述要求。因此,为进一步提升生物材料的各项性能,新型高强度低模量的新 β-钛合金的开发就变成了当务之急。
由于 β-钛合金其晶格结构为 bcc,较 hcp 结构的α-钛合金或α+β 相的钛合金相比拥有更低的弹性模量。Ozaki 等人[52]在 2004 年时采用传统铸造方法制作出致密的新型 β-Ti 合金 Ti-35Nb-2.5Sn,并测试其弹性模量为 50.7 GPa,仅为 Ti-6Al-4V 的一半。Zhang等人 [53]与 Hernandez 等人 [54]则分别采用 SLM 与EBSM 方法制造的致密 Ti-24Nb-4Zr-8Sn (Ti2448)合金,其弹性模量分别为 53 与 47 GPa,与其他传统制造方法制造该合金的结果相似[28,55],证明了用增材制造方法制造纯 β 钛合金的可行性。通过增加孔隙率,
Liu 等人[56]利用 EBSM 3D 打印方法进一步降低了Ti2448 合金材料零件的弹性模量。其实验中,当孔隙率为 70%时,Ti2448 的弹性模量仅为 0.7 GPa,抗压强度为 35 MPa,为完全消除应力屏蔽创造了理论基础。Liu 等人[57]在另一项的研究中,采用 SLM 方法实现了 85%孔隙率的 Ti2448 在维持弹性模量为 1 GPa的同时达到了 52 MPa 的抗压强度,基本达到了骨植入材料的理想力学性能要求。
对于长时间作为承力件的植入体零件,其疲劳强度同样十分重要。Edwards 等人[46]研究了 SLM 打印Ti-6Al-4V 合金块体材料的疲劳性能。其发现,由于加工冷却速度过快,3D 打印零件晶体内形成大量马氏体,材料内的残余应力无法释放。同时,因为材料的位错往往沿马氏体晶界展开,加之 3D 打印材料内部可能会由于粉末熔化烧结不完全,存有孔洞,直接加工后的表面质量不高,3D 打印的块体材料的疲劳强度远低于锻件[46]。同时,由于 3D 打印晶粒生长方向与加工方向密切相关,疲劳强度各向异性明显。因此 3D
打印后的零件需要进行适当的热处理以改善其力学性能。但对比其他多孔材料制备方法制造出的零件,3D打印方法生产出的零件的疲劳强度仍然较高。Li 等人[63]研究了 3D 打印多孔 Ti-6Al-4V 的疲劳强度。其利用 EBSM 方法制造了孔隙率在 60%~85%之间的Ti-6Al-4V 材料。通过对比不同结构的 Gibson-Ashby模型[64]的疲劳指数因子,发现 3D 打印规则 Ti-6Al-4V多孔材料的疲劳指数因子为随机多孔材料的两倍[63]。
说明 3D 打印是一种较为理想的多孔材料加工方法。
3.5 3D 打印钛合金生物相容性研究
对于生物医用合金的开发与设计研究,具有优异的生物相容性能是其重要的设计理念之一。利用 3D打印的钛合金医用材料,由于加工方式,导致零件表面粗糙度、孔隙度等均与传统加工方式制造的零件有所差异。因此,3D 打印医用钛合金的生物相容性同样十分值得研究。
对于传统的生物材料相容性的研究,研究者常着重于分析元素的细胞毒性、细胞繁衍分化程度等因素。但对于 3D 打印钛合金植入体而言,由于打印粉末原料大都采用现有合金成分,合金本身的生物学表现已经较明了。利用 3D 打印工艺制作的多孔材料与传统方法加工的合金相比,并不会对细胞分化、免疫反应等产生新的不利影响[10]。现有 3D 打印材料的生物相容性研究多集中于 3D 打印加工方法所带来的诸如粉末颗粒残留、表面粗糙度变化、孔尺寸大小等因素对生物学表现的影响上。
对于传统植入体,磨损产生的 5~10 µm 尺寸的碎屑会引起人体免疫系统过敏反应,已经成为生物材料的业界共识[65,66],此类碎屑经过复杂免疫反应过程后,会激活破骨细胞,导致骨消溶现象的发生[67]。由于 3D 打印工艺加工的多孔材料孔隙间隔较小以及粉末熔化不完全导致粉末粘连等因素,3D 打印材料孔隙内的细小粉末很难清理完全。Li 等人[68] 的研究证实,3D 打印后残留的细小粉末颗粒同样会引起类似的免疫系统反应,且随着粉末重复利用次数的增加,粉末粘结现象会加剧,致敏现象会更加严重[68]。因此,如
何正确处理打印加工后的样品是未来 3D 打印医用植入体需要考量的问题。
细胞黏附率是研究植入物早期生物相容性的一个重要指标。由于 3D 打印的特殊工艺,导致 3D 打印产品表面较为粗糙,为细胞早期攀附创造了理想条件。
同时,适当的热处理工艺可以进一步提高 3D 打印材料的表面粗糙度,进而提升骨细胞的黏附与骨结合。Li 等人[11]通过固溶+水冷的热处理工艺,增加了 3D打印 Ti-6Al-4V 的表面粗糙度。相比于未经处理的 3D打印零件,其早期细胞黏附率可提升约 50%,且后期骨长入率与骨结合强度均高于未经过处理的零件。
3D 打印多孔零件的孔型与孔径尺寸的设计也是3D 打印工艺设计过程中需要考虑的问题。由于 3D 打印具有极高的设计加工空间,3D 打印医用钛合金的孔型与大小设计十分丰富。对于孔形状的设计,虽有部分报道涉及孔形状对细胞黏附于增值的影响,但对于何种孔型对细胞更有促进效应,目前并无明确定论[69,70]。对于孔径尺寸的设计,由于该变量与材料的力学性能与骨细胞生长等因素密切相关,研究的关注度较多。Warnke 等人 [10]就曾利用 SLM 方法制备Ti-6Al-4V 合金 0.45~1.2 mm 孔径尺寸的多孔材料,在体外培养人成骨细胞,以研究不同孔径尺寸对骨结合性能的影响。其研究发现,当孔径大于 0.7 mm 时,成骨细胞数量逐渐减少,骨组织无法长满全部孔洞;孔尺寸为 0.5~0.6 mm 时,成骨细胞生长最为繁茂,可填满整个孔隙。Taniguchi 等人[71]则将 SLM 打印纯钛多孔材料植入兔子体内,并研究其在活体中的生物相容性与力学表现。其同样发现,0.6 mm 大小孔洞与其他孔径大小的孔洞(0.3 与 0.9 mm)相比,骨组织长入与结合能力更好。
4 、3D 打印医用钛合金问题与发展建议
随着 3D 打印技术的不断进步与发展,3D 打印医用钛合金产品逐步被医患所认知与接受。其技术优势对医疗领域的革命创新是显而易见的。然而,3D 打印医用钛合金领域仍存在许多问题有待完善。例如,3D 打印用粉末成本较高。目前,我国 3D打印用粉末的生产以旋转电极法和气雾化法为主,该类方法的细粉收得率不高,可用于 3D 打印的球形粉末出粉率基本低于 30%。同时,国内高端制粉设备仍以国外进口为主,粉末产品批次稳定性较差,导致制粉成本高昂,粉末售价为其原材料的 10 倍以上。
3D 打印用的钛合金粉末种类十分有限。受制于粉末生产技术与粉末生产成本的限制,市面上的钛合金3D 打印用粉末仍以纯钛或 Ti-6Al-4V 粉末为主。尽管近 20 年,各国研究者针对医用钛合金的需求研发了数款具有良好生物相容性的钛合金产品,但新型钛合金在 3D 打印上的研究与应用仍十分有限。
3D 打印产品的性能稳定性有待提高。受限于粉末批次稳定性与设备工艺的限制,3D 打印所得产品的稳定性同样不佳。由于各厂商生产粉末的物理性能与化学性能均有所差异,导致打印工作前常需要根据粉末性能调整摸索加工工艺参数。打印过程中无法对加工过程进行实时监控与评价,难以及时发现问题,对 3D打印工程师的技术水平与经验要求较高。
3D 打印零件组织缺陷难以避免。由于 3D 打印钛合金的过程中,打印零件冷却速度较快,难以避免的出现马氏体组织。且加工过程中不均匀温度场引起的残余应力难以释放,严重时可能造成零件变形。加工方式导致 3D 打印材料各项异性明显。因此 3D 打印零件的加工过程控制及零件的后续处理值得深入研究。
对于 3D 打印植入物产品没有完善的评价体系。尽管自 2010 年 FDA 颁发了首张 3D 打印骨科植入产品的许可证起,FDA 已经批准了上百种 3D 打印的医疗器械产品,但其中金属植入物产品及种类仍有限,且绝大多数为脊柱椎体、椎间融合器与髋臼杯等统一设计的产品。对于针对患者定制的个性化产品,由于FDA 与 CFDA 对于 3D 打印产品并无单独的评价体系,导致此类产品很难获得市场准入认证,仅能停留在临床试验阶段,无法发挥 3D 打印医疗器械的最大优势。
综上所述,对于促进 3D 打印医用钛合金在医疗领域的进一步发展,以下工作有待进一步推进:
1) 改进金属球形粉末制备方法,建立 3D 打印金属粉末原料的标准与规范,提高 3D 打印用粉末细粉收得率与批次稳定性。
2) 增加 3D 打印粉末的多样化,尽快引入新型医用钛合金在 3D 打印上的应用与研究。通过与材料基因组研究计划的结合,突破现有材料瓶颈,开发更适合 3D 打印工艺的新材料。
3) 建立设备-材料-工艺的协同发展机制,制定针对材料与设备相结合的 3D 打印加工工艺,以生产出性能更优异、批次稳定性更强的 3D 打印产品。
4) 加大 3D 打印材料及方法在医疗应用准入许可上的推动力度,针对 3D 打印加工方法,设立相关国家和行业标准与评价体系,降低 3D 打印技术的推广应用门槛,使这项技术造福于民。
参考文献 References
[1] Geetha M, Singh A K, Asokamani R et al. Progress inMaterials Science[J], 2009, 54(3): 397
[2] Wang Yunfeng(王运锋), He Lei(何 蕾), Guo Wei(郭 薇).Titanium Industry Progress(钛工业进展)[J], 2015, 32(1): 1
[3] Liu P S, Liang K M. Journal of Materials Science[J], 2001,36(21): 5059
[4] Wen C E, Mabuchi M, Yamada Y et al. Scripta Materialia[J],2001, 45(10): 1147
[5] Li J P, Li S H, Groot K D et al. Preparation andCharacterization of Porous Titanium[C]. Switzerland:Trans Tech Publications, 2002: 51
[6] Zhang Q Y, Leng Y, Xin R L. Biomaterials[J], 2005, 26(16):2857
[7] Kitaoka K, Yamamoto H, Toshikazu Tani et al. Journal ofOrthopaedic Science[J], 1997, 2(2): 106
[8] He G, Liu P, Tan Q B. Journal of the Mechanical Behavior ofBiomedical Materials[J], 2012, 5(1): 16
[9] Xu Guangsheng( 徐 广 胜 ), Kou Hongchao( 寇 宏 超 ), LiuXianghong( 刘 向 宏 ) et al. Rare Metal Materials andEngineering(稀有金属材料与工程)[J], 2014, 43(11): 2778
[10] Warnke P H, Douglas T, Wollny P et al. TissueEngineering Part C: Methods[J]. 2009, 15(2): 115
[11] Li Z H, Liu C, Wang B F et al. RSC Advances[J], 2018,8(22): 12 471
[12] Bothe T R. Sur Gynecol Obst[J], 1940, 71(6): 598
[13] Leventhal G S. J Bone Joint Surg Am[J], 1951, 33(2): 473
[14] Yu Zhentao(于振涛), Yu Sen(余 森), Zhang Minghua(张明华) et al. Materials China(中国材料进展)[J], 2010(12): 35
[15] Noort R V. Journal of Materials Science[J], 1987, 22(11):3801
[16] Reilly D T, Albert H Burstein. The Journal of Bone &Amp;Joint Surgery[J], 1974, 56(5): 1001
[17] Goldstein S A. Journal of Biomechanics[J], 1987, 20(11):1055
[18] Boyce B F, Byars J, Williams S Mc et al. Journal ofClinical Pathology[J], 1992, 45(6): 502
[19] Niinomi M, Nakai M, Hieda J. Acta Biomaterialia[J], 2012,8(11): 3888
[20] Aschner M, Costa L G. Neurotoxicity of Metals[M]. NewYork: Springer International Publishing, 2017: 183
[21] Steinemann S G. Evaluation of Biomaterials[J], 1980, 1: 1
[22] Niinomi M. Biomaterials[J], 2003, 24(16): 2673[23] Stenlund P,Omar O,Brohede U et al. ActaBiomaterialia[J], 2015, 20: 165
[24] Bai Y, Li S J, Prima F et al. Applied Surface Science[J],2012, 258(8): 4035
[25] Yu S, Yu Z T, Wang G et al. Colloids and Surfaces B:Biointerfaces[J], 2011, 85(2): 103
[26] Niinomi M. Materials Science and Engineering A[J], 1998,243(1-2): 231
[27] Besse M, Castany P, Gloriant T. Acta Materialia[J], 2011,59(15): 5982
[28] Zhang S Q, Li S J, Jia M T et al. Scripta Materialia[J], 2009,60(8): 733
[29] Kent D, Wang G, Yu Z et al. Materials Science andEngineering: A[J], 2010, 527(9): 2246
[30] Li S J, Zhao S, Hou W T et al. Advanced EngineeringMaterials[J], 2016, 18(1): 34
[31] Stamp R, Fox P, O′ Neill W et al. J Mater Sci Mater Med[J],2009, 20(9): 1839
[32] Mullen L, Stamp R C, Fox P et al. J Biomed Mater Res BAppl Biomater[J], 2010, 92(1): 178
[33] Sallica-Leva E, Jardini A L, Fogagnolo J B . Journal of theMechanical Behavior of Biomedical Materials[J], 2013, 26: 98
[34] Frazier W E. Journal of Materials Engineering andPerformance [J], 2014, 23(6): 1917
[35] Vayre B, Vignat F, Villeneuve F. Mechanics & Industry[J],2012, 13(2): 89
[36] Murr L E, Gaytan M, Ramirez D A et al. Journal ofMaterials Science & Technology[J], 2012, 28(1): 1
[37] Attar H, Bönisch M, Calin M et al. Journal of MaterialsResearch[J], 2014, 29(17): 1941
[38] Jardini A L, Larosa M A, Filho R M et al. Journal ofCranio-Maxillofacial Surgery[J], 2014, 42(8): 1877
[39] Spetzger U, Frasca M, König S A. European SpineJournal[J], 2016, 25(7): 2239
[40] Noort R van. Dent Mater[J], 2012, 28(1): 3[41] Wang S, Wang L, Liu Y et al. Experimental andTherapeutic Medicine[J], 2017, 14(3): 2595
[42] Abe F, Santos E C, Kitamura Y et al. Proceedings of theInstitution of Mechanical Engineers, Part C[J], 2003,217(1): 119
[43] Attar H, Calin M, Zhang L C et al. Materials Science andEngineering: A[J], 2014, 593: 170
[44] Hrabe N, Gnäupel-Herold T, Quinn T. InternationalJournal of Fatigue[J], 2017, 94: 202
[45] Attar H, Prashanth K G, Chaubey A K et al. MaterialsLetters[J], 2015, 142: 38
[46] Edwards P, Ramulu M. Materials Science and Engineering:A[J], 2014, 598: 327
[47] Mercelis P, Kruth J P. Rapid Prototyping Journal[J], 2006,12(5): 254
[48] Thijs L, Verhaeghe F, Craeghs T et al. Acta Materialia[J],2010, 58(9): 3303
[49] Murr L E, Esquivel E V, Quinones S A et al. MaterialsCharacterization[J], 2009, 60(2): 96
[50] Gu D, Hagedorn Y C, Meiners W et al. Acta Materialia[J],2012, 60(9): 3849
[51] Vrancken B, Thijs L, Kruth J P et al. Acta Materialia[J],2014, 68: 150
[52] Ozaki T, Matsumoto H, Watanabe S et al. MaterialsTransactions [J], 2004, 45(8): 2776
[53] Zhang L C, Klemm D, Eckert J et al. Scripta Materialia[J],2011, 65(1): 21
[54] Hernandez J, Li S J, Martinez E et al. Journal of MaterialsScience & Technology[J], 2013, 29(11): 1011
[55] Li S J, Cui T C, Hao Y L et al. Acta Biomaterialia[J], 2008,4(2): 305
[56] Liu Y J, Li S J, Hou W T et al. Journal of Materials Science& Technology[J], 2016, 32(6): 505
[57] Liu Y J, Li X P, Zhang L C et al. Materials Science andEngineering A[J], 2015, 642: 268
[58] Mullen L, Stamp R C, Brooks W K et al. J Biomed MaterRes B Appl Biomater[J], 2009, 89(2): 325
[59] Pattanayak D K, Matsushita T, Takadama H et al.Bioceramics Development and Applications[J], 2010, 1: 1
[60] Li S J, Xu Q S, Wang Z et al. Acta Biomaterialia[J], 2014,10(10): 4537
[61] Cheng X Y, Li S J, Murr L E et al. J Mech Behav BiomedMater[J], 2012, 16: 153
[62] Ahmadi S, Yavari S, Wauthle R et al. Materials[J], 2015,8(4): 1871
[63] Li S J, Murr L E, Cheng X Y et al. Acta Materialia[J], 2012,60(3): 793
[64] Gibson L J, Ashby M F. Cellular Solids: Structure andProperties [M]. Cambridge: Cambridge University Press,1999
[65] Saldaña L, Vilaboa N. Acta Biomaterialia[J], 2010, 6(4):1649
[66] Akisue T, Thomas W B, Carol F F et al. Journal ofBiomedical Materials Research[J], 2001, 59(3): 507
[67] Lin T H, Yao Z Y, Sato T S et al. Acta Biomaterialia[J],2014, 10(8): 3747
[68] Li C D, Jiang C, Peng M Z et al. RSC Advances[J], 2018,8(4): 2229
[69] Markhoff J, Wieding J, Weissmann V et al. Materials[J],2015, 8(8): 5490
[70] Bael S Van, Chai Y C, Truscello S et al. Acta Biomater[J],2012, 8(7): 2824
[71] Taniguchi N, Fujibayashi S, Takemoto M et al. MaterialsScience and Engineering C[J], 2016, 59: 690
相关链接



















